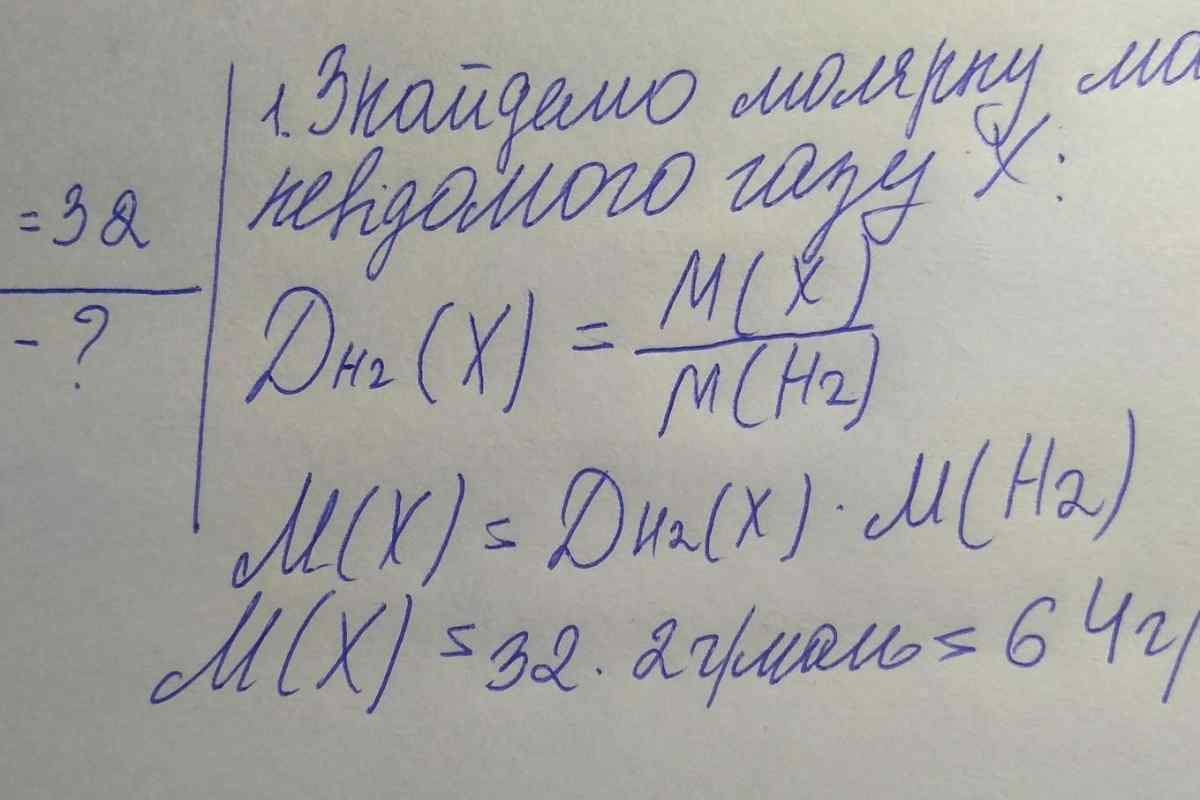У класичних завданнях з хімії часто зустрічається термін "" молярний об 'єм "". В основі способу визначення цієї величини лежить закон Авогадро, який справедливий для ідеальних газів. Знаючи молярний об 'єм газу, можна знайти кількість речовини, масу і молярну масу цього газу.
Інструкція
1. Ще в 1811 році італійським фізиком А. Авогадро була встановлена закономірність, яка розглядалася тільки для ідеальних газів: pV = m/MRTТеоретично це означає, що в рівних обсягу х різних газів при однакових тиску і температураї знаходиться одне і те ж число молекул.
2. Потім італійський хімік С. Канніцаро розглянув цей закон з хімічної точки зору, в основі якої лежить атомно-молекулярне вчення. При цьому, виникло слідство із закону Авогадро, який говорить, що за однакових умов рівна кількість різних газів займає рівний обсяг. При нормальних умовах, тобто при T = 273,15 К, po = 1,01325 * 10 ^ 5 Па, один моль будь-якого газу, незалежно від його хімічного складу, займає обсяг 22.4 л. Це і є молярний об 'єм газу, який може бути виражений наступним чином:Vm = Vb/nb [л/моль] Vm = 22,4 л/мольВідповідно, nb = Vb/Vm [л/( л/моль)]; вираз [л/( л/моль)] можна скоротити, отже, обчислювана за цією формулою величина вимірюється в молях.
3. Молярний обсяг - величина постійна і на її підставі можуть бути визначені обсяг газу і кількість речовини. Зазвичай, якщо кількість речовини відома, завдання вирішується за формулою, представленою вище. Але як вчинити, якщо відомі лише молярний об 'єм, формула речовини і його маса? У цьому випадку, слід керуватися наступним:При відомій масі виходить, що nb = m/Mв-ва Спочатку слід знайти молярну масу речовини, а потім, поділивши масу на молярну масу отримати його кількість. Виходячи з цього, вже може бути знайдений Vb, який дорівнює:Vb = Vm * nb = Vm * m/MПреобразовав вказаний вираз відповідним чином, можна обчислити будь-яку з фігуруючих у ньому величин, за умови, що відомі всі інші. Це дозволяє вирішувати з використанням даної формули досить широке коло хімічних завдань, що зустрічаються як в шкільному або вузівському курсі хімії, так і в повсякденній практиці професійного хіміка-експериментатора.